相平衡理论--二元系(1)
- 发布人:管理员
- 发布时间:2014-04-17
- 浏览量:832
MgO-FeO二元系
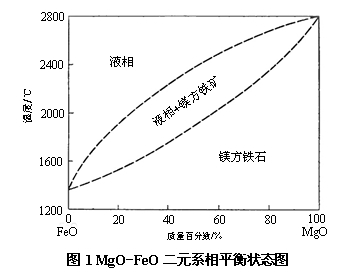
当方镁石与含铁介质或在还原气氛下与铁氧化物接触时,根据加热温度的高低以及还原气氛的强弱可以形成MgO-FeO-Fe三元系或MgO-FeO二元系。一般来说,温度越高,还原气氛越强,越容易形成MgO-FeO-Fe三元系。如果Fe的含量很少、可以忽略不计时,则MgO和FeO能生成连续固溶体 [(Mg, Fe)O],一般称之为镁方铁矿。其平衡状态图如图1所示。
MgO-Fe2O3二元系
当方镁石与铁的氧化物在氧化性气氛中接触时,MgO与Fe2O3在600℃下即开始形成铁酸镁(MgO·Fe2O3,简写为MF)。铁酸镁具有尖晶石类结构(R2+O·R23+O3),故又称之为镁铁尖晶石。MgO-Fe2O3二元系的相平衡状态图如图2所示。
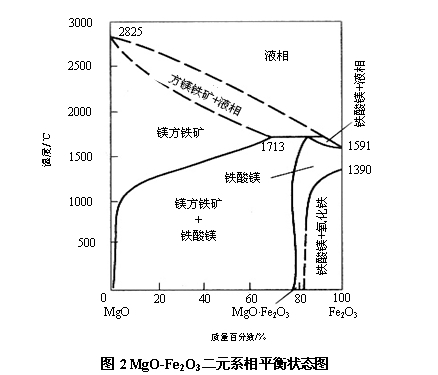
铁酸镁是MgO-Fe2O3二元系中唯一的二元化合物,其理论化学组成为MgO:20.1%,Fe2O3:79.9%。在温度高于1713℃时分解为镁方铁矿和液相。
铁酸镁在1000℃以上可以显著地固溶于方镁石中,形成镁方铁矿。Fe2O3的溶解度随着温度的升高而增大,在接近1713℃时达到最大,为70%。虽然铁酸镁在1713℃下分解出现液相,但当其固溶于方镁石中形成镁方铁矿后,可以使其出现液相的温度升高。铁酸镁在方镁石中溶解后,由于形成的阳离子类晶格内有空位的异价型固溶体,并储存了较高的晶体能量,提高了活性,因此,可以明显改善方镁石的烧结性能。
值得注意的是,严格说来,在一定条件下,很难有MgO-Fe2O3二元系的相平衡,而只有MgO-Fe2O3-FeO三元系相平衡存在。
MgO-Al2O3二元系
在镁质耐火材料中,由于天然原料中含有少量的Al2O3杂质,另外,为了改善镁质耐火材料的使用性能,有时还人为地向镁质耐火材料中加入部分Al2O3组分。当将方镁石同Al2O3一起加热至1500℃以上时,即可经固相反应形成镁铝尖晶石(MgO·Al2O3,简写为MA)。MgO-Al2O3二元系相图如图3所示。
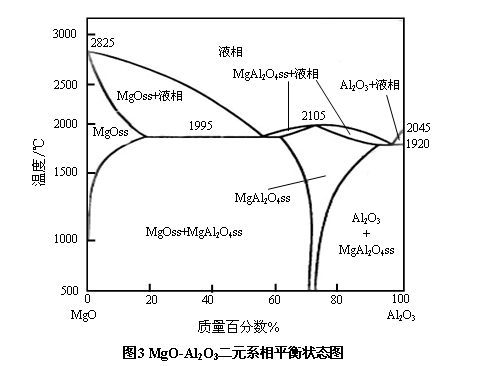
由图3可见,镁铝尖晶石是MgO-Al2O3二元系中唯一的一个二元化合物,常简称为尖晶石。其理论化学组成为MgO:28.3%,Al2O3:71.7%,熔点高达2105℃。在MgO-MgO·Al2O3体系内,最低共熔温度约为1995℃。
由MgO-Al2O3二元系相图可知,方镁石与尖晶石在1500℃以上有明显互溶现象,并形成固溶体,且随温度的升高,溶解量增多。在1995℃,方镁石中可固溶16%的Al2O3,尖晶石中可固溶10%左右的MgO。虽然方镁石与尖晶石的最低共熔温度为1995℃,但在方镁石中溶解Al2O3或在尖晶石中溶解MgO形成固溶体后,出现液相的温度却皆高于此方镁石和尖晶石两相的最低共熔点。
MgO-Cr2O3二元系
在镁铬砖中,Cr2O3含量多在10~40%之间。因此,无论是直接结合镁铬砖,还是再结合镁铬砖,除了含有方镁石等矿物外,还含有MgO和Cr2O3的反应产物-镁铬尖晶石(MgO·Cr2O3,简写为MC或MK)。此种尖晶石与方镁石的相平衡状态图如图4所示。
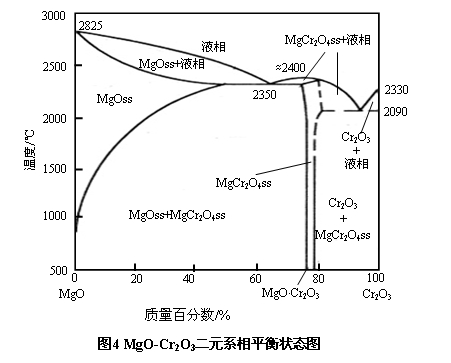
由图4可见,镁铬尖晶石是MgO-Cr2O3系统中唯一的一个二元化合物。其理论化学组成为MgO:21%,Cr2O3:79%。在自然界中,很少有纯镁铬尖晶石存在,多与其他金属离子构成复合尖晶石,一般形式为(M,Fe)O·(Cr,Al,Fe)2O3。镁铬尖晶石的熔点约为2400℃,MgO-MgO·Cr2O3体系的最低共熔温度也高于2300℃。此种尖晶石同铁酸镁和镁铝尖晶石相似,与方镁石在高温下也可互溶,溶解量随温度升高而增大,并且在冷却过程中析出。但溶解的起始温度和溶解最高量不尽相同。在1600℃时方镁石中可固溶10%以上的Cr2O3;在2350℃附近Cr2O3固溶量高达50%,介于MgO·Fe2O3和MgO·Al2O3之间。
上一篇:相平衡理论-相平衡
下一篇:相平衡理论--二元系(2)





