MgO-C以及MgO-CaO-C体系热力学
- 发布人:管理员
- 发布时间:2014-05-21
- 浏览量:930
在高温下,MgO-C体系内可能存在的主要反应有三个,分别为:
![]()
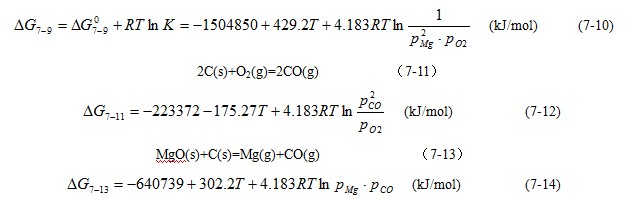
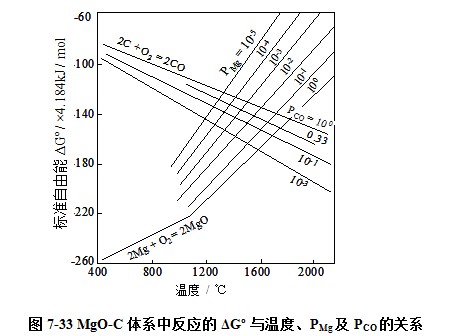
当体系内的反应达到平衡时,ΔG=0。可根据上述各式可以计算出各温度下反应(7-9)和(7-11)的ΔGº以及PMg和PCO值,所得结果如图7-33所示。根据此图可查出纯MgO与纯石墨反应生成镁蒸汽和一氧化碳气体时的开始反应温度。例如,当PMg和PCO分别为1atm时,MgO-C的开始反应温度为1870℃,而当PMg和PCO分别降至0.001atm时,MgO-C的开始反应温度则降低为1248℃。
MgO-C反应体系是一个三元素(C,Mg,O)五组分(C,CO,O2,Mg,MgO)的体系,体系的独立反应仅有(5−3)=2个。若取2MgO(s)=2Mg(g)+O2(g)及MgO(s)+C(s)=Mg(g)+CO(g)为独立反应,当T=1600ºC时,有:
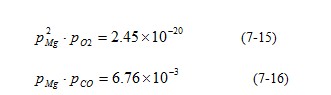
上述方程组中含有三个未知数,必须还有一个方程才能解出。
在封闭体系中,由于碳过剩,氧压很低,故与pCO及pMg相比,可忽略不计,且反应体系中的Mg和CO都是通过反应MgO(s)+C(s)=Mg(g)+CO(g)产生的,即:
![]()
解(7-15)~(7-17)方程组,可得pMg=pCO=8.22×10-3MPa,PO2=3.71×10-16MPa。
对于一个敞开体系,在碳过剩的条件下,气氛中的CO压力接近于大气压,即,pCO=1atm。这时,如果取2Mg(g)+O2(g)=2MgO(s)及2C(s)+O2(g)=2CO(g)两个反应为基本反应,则可得如下三个方程:

在这个体系内有三个主要气相,即,Ca,Mg和CO。在温度一定的条件下,若求出其各自得平衡分压PCa,pMg和pCO,除了上述的式(7-22)和式(7-24)之外,尚需另一个方程式。
由反应(7-21)及(7-23)可知,1mol碳和1mol氧化镁或者1mol氧化钙反应生成1mol一氧化碳及1mol镁蒸气或1mol钙蒸气。所以,体系中一氧化碳的分压PCO应等于镁蒸气压PMg和钙蒸气压PCa之和,即:

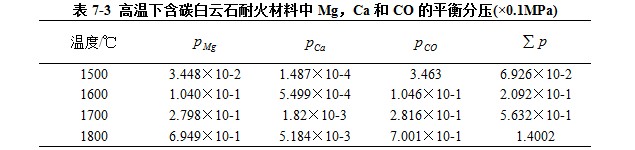
根据以上三式,可计算出各温度下的PMg, PCa和pCO ,所得结果列于表7-3中。需要说明的是,在计算中认为白云石为MgO和CaO的单纯混合物,且它们的活度都等于1。
在碱性耐火材料中,除了CaO之外,常常还含有SiO2杂质。因此,在实际计算中有时还必须考虑SiO2的影响。在MgO-CaO-SiO2-C体系内,可能发生的反应有:

在MgO-CaO-SiO2-C体系内,MgO、CaO和C 主要是以纯固态形式存在,因此它们的活度为1。但是,SiO2则多是以化合物或固溶体的形式存在的,因此其活度不等于1。根据相关研究结果,在1600℃下,MgO–CaO–SiO2体系中SiO2的活度为0.17。如果认为在所讨论的温度范围内没有太大的变化。于是有:
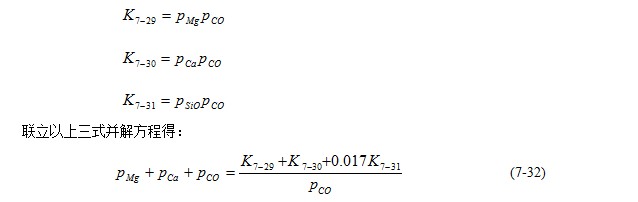
反应式(7-29)、(7-30)以及(7-31)表明,1mol碳和1molMgO或1molCaO或1molSiO2反应将分别生成1molCO和1molMg或1molCa或1molSiO2。因此,如果在此体系内3个反应都发生,CO的mol数一定等于Mg、Ca、SiO的总mol数。而体系内的气相分压又与气体的mol数成比例,故有:
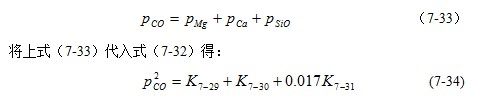
由平衡常数Kp与温度的关系式,可以求出不同温度下的K7-29、K7-30以及K7-31。将这些值代入上式,即可求得不同温度下的pco。由pco就可以算出不同温度下的pMg、PCa和pSiO。其计算结果如表7-4所示。
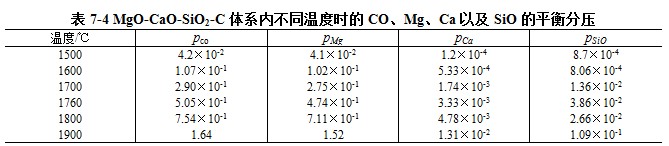
由表可以看出,在1760℃时,反应产物的总压将达到1个大气压。这说明当温度高于1760℃时,MgO-CaO-SiO2-C体系内自耗反应将很激烈的进行。另外,由于SiO2的活度小,故SiO的分解压是比较小的,但是当SiO2的活度很大时,SiO的分压就会增大。
上一篇:MgO-H2O体系热力学
下一篇:扩散与扩散的宏观动力学方程





